Teori ikatan valensi (VB) adalah teori ikatan kimia yang menjelaskan bahan kimia tersebut ikatan antara dua atom. Seperti teori orbital molekul (MO), teori ini menjelaskan ikatan menggunakan prinsip-prinsip mekanika kuantum. Menurut teori ikatan valensi, ikatan disebabkan oleh tumpang tindih atom yang setengah terisi orbital. Kedua atom berbagi elektron tidak berpasangan satu sama lain untuk membentuk orbital terisi untuk membentuk a orbital hybrid dan ikatan bersama. Sigma dan obligasi pi adalah bagian dari teori ikatan valensi.
Pengantar Kunci: Teori Valensi Obligasi (VB)
- Teori ikatan valensi atau teori VB adalah teori yang didasarkan pada mekanika kuantum yang menjelaskan cara kerja ikatan kimia.
- Dalam teori ikatan valensi, orbital atom masing-masing atom digabungkan untuk membentuk ikatan kimia.
- Teori utama lain dari ikatan kimia adalah teori orbital molekul atau teori MO.
- Teori ikatan valensi digunakan untuk menjelaskan bagaimana ikatan kimia kovalen terbentuk antara beberapa molekul.
Teori
Teori ikatan valensi memprediksi pembentukan ikatan kovalen antara atom ketika mereka memiliki orbital atom valensi yang setengah terisi, masing-masing berisi satu elektron yang tidak berpasangan. Orbital atom ini tumpang tindih, sehingga elektron memiliki probabilitas tertinggi berada di dalam wilayah ikatan. Kedua atom kemudian berbagi elektron tak berpasangan tunggal untuk membentuk orbital yang berpasangan lemah.
Kedua orbital atom tidak harus sama satu sama lain. Misalnya, ikatan sigma dan pi mungkin tumpang tindih. Ikatan sigma terbentuk ketika dua elektron bersama memiliki orbital yang tumpang tindih head-to-head. Sebaliknya, ikatan pi terbentuk ketika orbital tumpang tindih tetapi sejajar satu sama lain.
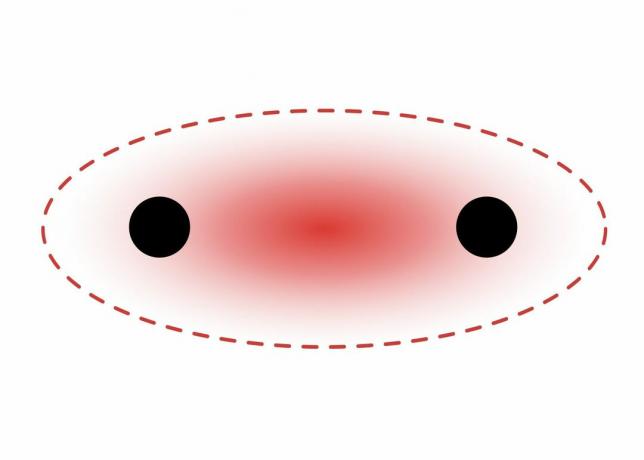
Ikatan sigma terbentuk antara elektron dua orbital s karena bentuk orbitalnya berbentuk bola. Ikatan tunggal mengandung satu ikatan sigma. Ikatan rangkap mengandung ikatan sigma dan ikatan pi. Ikatan rangkap tiga berisi ikatan sigma dan dua ikatan pi. Ketika ikatan kimia terbentuk antara atom-atom, orbital atom mungkin merupakan hibrida dari ikatan sigma dan pi.
Teori ini membantu menjelaskan pembentukan ikatan dalam kasus di mana a Struktur lewis tidak dapat menggambarkan perilaku nyata. Dalam hal ini, beberapa struktur ikatan valensi dapat digunakan untuk menggambarkan striktur Lewis tunggal.
Sejarah
Teori ikatan valensi diambil dari struktur Lewis. G.N. Lewis mengusulkan struktur ini pada tahun 1916, berdasarkan pada gagasan bahwa dua elektron ikatan bersama membentuk ikatan kimia. Mekanika kuantum diterapkan untuk menggambarkan sifat ikatan dalam teori Heitler-London tahun 1927. Teori ini menggambarkan pembentukan ikatan kimia antara atom hidrogen dalam molekul H2 menggunakan persamaan gelombang Schrödinger untuk menggabungkan fungsi gelombang dari dua atom hidrogen. Pada tahun 1928, Linus Pauling menggabungkan ide ikatan pasangan Lewis dengan teori Heitler-London untuk mengusulkan teori ikatan valensi. Teori ikatan valensi dikembangkan untuk menggambarkan resonansi dan hibridisasi orbital. Pada tahun 1931, Pauling menerbitkan sebuah makalah tentang teori ikatan valensi berjudul, "Pada Sifat Ikatan Kimia." Program komputer pertama yang digunakan untuk menggambarkan ikatan kimia menggunakan teori orbital molekul, tetapi sejak 1980-an, prinsip-prinsip teori ikatan valensi telah menjadi dapat diprogram. Saat ini, versi modern dari teori-teori ini saling bersaing dalam hal menggambarkan perilaku nyata secara akurat.
Penggunaan
Teori ikatan valensi sering dapat menjelaskan caranya ikatan kovalen bentuk. Itu diatomik molekul fluor, F2, adalah contohnya. Atom fluorin membentuk ikatan kovalen tunggal satu sama lain. Ikatan F-F hasil dari tumpang tindih halz orbital, yang masing-masing berisi satu elektron tak berpasangan. Situasi serupa terjadi pada hidrogen, H2, tetapi panjang dan kekuatan ikatan berbeda antara H2 dan F.2 molekul. Ikatan kovalen terbentuk antara hidrogen dan fluor dalam asam fluorida, HF. Ikatan ini terbentuk dari tumpang tindih hidrogen 1s orbital dan fluorin 2halz orbital, yang masing-masing memiliki elektron tidak berpasangan. Dalam HF, baik atom hidrogen dan fluor berbagi elektron ini dalam ikatan kovalen.
Sumber
- Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "Struktur elektronik molekul benzena." Alam. 323 (6090): 699. doi:10.1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter A. (1987). "Struktur elektronik molekul benzena." Alam. 329 (6139): 492. doi:10.1038 / 329492a0
- Murrell, J.N.; Kettle, S.F.A.; Tedder, J.M. (1985). Ikatan Kimia (2nd ed.). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "Struktur elektronik molekul benzena." Alam. 325 (6103): 396. doi:10.1038 / 325396d0
- Shaik, Sason S.; Phillipe C. Hiberty (2008). A Chemist's Guide to Valence Bond Theory. New Jersey: Wiley-Interscience. ISBN 978-0-470-03735-5.